Control de los abortos por pestivirus a través de un caso práctico

PRIMERA SESIÓN / Seminario sobre Control de Abortos (MSD Animal HEALH)
ANTÓN ESNAL. Director técnico de Analítica Veterinaria.
Los pestivirus son agentes responsables de abortos en pequeños rumiantes. En el caso del ovino, son más conocidos como ‘virus Border’. El objetivo de la presentación es abordar aquellos aspectos prácticos que puedan ser más interesantes relacionados con este agente causante de abortos y canalizarlo con la descripción de un caso clínico concreto, con las medidas que se han puesto en marcha para conseguir el control y erradicación del agente en la explotación.
VIRUS BORDER
El virus Border es un pestivirus, género del virus en el que están incluidos los dos genotipos causantes de la diarrea vírica bovina o el virus causante de la peste porcina clásica, además del genotipo causante del virus Border del ovino. En total, son cuatro virus íntimamente relacionados. Están tan relacionados que está documentada, tanto desde el punto de vista de infecciones experimentales como desde el punto de vista de descripciones de casos clínicos reales en campo, la transmisión cruzada entre todas las especies: vacuno, porcino y ovino. Tiene especial relevancia la transmisión cruzada de virus entre el ganado vacuno y el ganado ovino. En el caso de la transmisión del ganado ovino a vacuno, tiene una menor repercusión clínica y son más anecdóticos los casos documentados, pero tiene una importancia crucial en los planes de erradicación de enfermedades en el ganado vacuno, en el que se hacen seguimientos a través de la serología. El contacto de los ovinos infectados con el ganado vacuno conduce a seroconversiones, que se pueden interpretar como vacas que han tenido contacto con un pestivirus, cuando en realidad podía no ser el del ganado vacuno. De las vacas a las ovejas, tiene una repercusión clínica más importante, hasta el punto de que el virus Border no se puede circunscribir únicamente al genotipo ovino, sino que debemos considerar que en el virus Border intervienen el genotipo ovino y el propio BVD. De hecho, cuando se hacen descripciones víricas en ovino en determinados países, el porcentaje de virus identificado como genotipo bovino es realmente relevante, en porcentajes que rondan el 25%.
Los pestivirus son pandémicos en todo el mundo, con unas prevalencias publicadas muy variables, entre el 5% y el 50%. En España hay publicaciones que establecen prevalencias entre el 18% y el 36%. En el caso de Analítica Veterinaria, tenemos establecidas unas incidencias de abortos del 2% al 5%, con variaciones anuales de abortos causados por pestivirus, con una seroprevalencia del 30%, aunque esa seroprevalencia está sesgada, porque está recogida de muestras de animales que son enviados al laboratorio porque han abortado.
Cuando se produce la infección de un animal después del nacimiento, se produce una infección leve y, en la inmensa mayoría de los casos, inaparente durante el periodo que dura la viremia, que está entre 4 y 14 días. Se puede producir una ligera fiebre y una leucopenia, que puede traducirse en un periodo transitorio de inmunodepresión. Cuando la llegada del virus a un rebaño se produce cuando el rebaño no tiene una defensa inmune frente a este virus y se produce un contagio generalizado, en ese periodo transitorio puede producirse un periodo de inmunodepresión colectiva a nivel de rebaño. A partir de la finalización de la viremia, el animal desarrolla una inmunidad que es efectiva, persistente y protectora en la mayor parte de los casos. El animal vence la viremia y se mantiene totalmente sano durante un tiempo indefinido. Por lo tanto, ese animal no queda como portador.
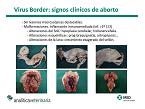
Cuando se infecta una hembra gestante, se va a producir un cuadro reproductivo con diferentes manifestaciones. En muchos casos se produce una muerte fetal en cualquier momento de la gestación, desde reabsorciones o ‘abortos en sangre’ cuando se produce una infección temprana hasta la expulsión de fetos en diferentes estados gestacionales, o incluso el nacimiento de corderos débiles, mortinatos o corderos que tienen una sintomatología clínica que ya nos pueden hacer sospechar que el pestivirus puede ser uno de los agentes a investigar. Uno de esos síntomas es el cordero con temblores, que pueden ser reversibles si ese cordero es viable y se mantiene con vida los suficientes meses. Por último, puede darse el nacimiento de corderos totalmente normales, asintomáticos, y que no harían sospechar que están infectados por el virus.
Se producen abortos sin ningún tipo de manifestación macroscópica o lesional y, en ocasiones, se pueden producir malformaciones, que ayudan a orientar el diagnóstico. Las malformaciones se suelen producir en edades gestacionales relativamente avanzadas, especialmente en fetos que ya están en el segundo tercio de gestación para adelante. Se enfrenta una infección virémica muy agresiva con un feto que ya tiene un sistema inmune desarrollado. Por lo tanto, se van a producir unos fenómenos inflamatorios que son los generadores de malformaciones, que están localizadas a tres niveles: en el sistema nervioso central, produciéndose alteraciones de cerebelo y encéfalo, con hidranencefalia, hipoplasia cerebral e hipoplasia cerebral; en el sistema articular con artogriposis o prog-braquignatia; o en la formación de la lana.
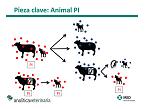
Ya se ha señalado con anterioridad que los animales se infectan, tienen una viremia transitoria y después vencen la enfermedad, por lo que quedan como animales sanos que han vencido la infección. Así, parece que la enfermedad tendría que ser algo muy transitorio en el rebaño: entra el virus, se produce un pase colectivo y los animales vencen la enfermedad. Sin embargo, el virus Border permanece en la explotación porque hay una figura epidemiológicamente clave, que es el animal persistentemente infectado (PI).
El desarrollo de la inmunidad en el feto se desarrolla aproximadamente entre los días 60 y 85 de gestación. Cuando el feto se infecta y ya es inmunocompetente, intenta vencer a la enfermedad. Si no lo consigue, se va a producir una muerte fetal o neonatal, o el animal vence a la infección y nace de una forma viable y sana. Ese cordero viable es inmunocompetente, seropositivo, sano y no portador del virus. Sin embargo, si el animal se infecta antes de haber desarrollado la capacidad inmune, se puede producir la muerte del feto o un cordero viable, porque es capaz de sobrevivir a la infección vírica. En este caso, el animal será inmunotolerante, por lo que no va a desarrollar inmunidad, por lo que será virémico persistente. Estará infectado durante toda su vida, no genera anticuerpos y será siempre portador y excretor del virus. Ese es un animal PI.
Un animal PI, tanto de adulto como de cordero, tiene una capacidad infectante brutal, ya que es un virus muy contagioso. Desde el momento en el que está en contacto con otros animales vivos, va a producir contagios a otros animales sin mayores repercusiones, con una viremia transitoria. Existe una salvedad, ya que hay casos documentados de una clínica importante en corderos con cepas especialmente agresivas. En principio, son repercusiones escasas. Sin embargo, cuando un animal PI contagia a un animal gestante, no va a tener sintomatología ni se va a ver afectado clínicamente, pero se produce una infección fetal que producirá un feto o un cordero viable y sano. Si el animal gestante se ha infectado antes de los 60 o 85 días de gestación, puede dar lugar al nacimiento de un nuevo animal PI. Por otro lado, un PI también puede quedar gestante, ya que puede ser sano y fértil, por lo que dará lugar a un aborto o un nuevo cordero PI viable. De esta forma, se perpetúa la infección en la explotación.
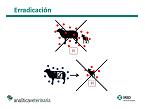
La erradicación pasa por eliminar los PI de la explotación. No hay que olvidar que la erradicación debe constar de dos fases. Se deben buscar los animales portadores en un momento determinado de la explotación para eliminar los persistentes, sin olvidar que pueden existir PI en los úteros de algunas madres de las explotaciones que parirán posteriormente. Por lo tanto, ese seguimiento debe alargarse hasta el momento que hayan parido todas las hembras que estén gestantes en el momento que hayamos hecho la búsqueda de portadores.
EJEMPLO PRÁCTICO
Desde Analítica Veterinaria trabajamos en un caso clínico en una explotación en concreto. Es un rebaño Assaf, con unas 1.000 hembras reproductoras y 41 machos. Es un rebaño cerrado, con una alta reposición, con cuatro parideras al año y un manejo sanitario convencional, con vacunaciones de paratuberculosis, basquilla, agalaxia, mamitis, vacunación viva de clamidias desde el año 2013, tratamientos de secado intramamarios...
Es un rebaño que registra índices reproductivos de forma bastante sistemática y que permiten reconocer fácilmente un problema de abortos. Desde el 2014, los índices de abortos no bajan del 7%, con picos de hasta el 28% en el año 2016. Es un problema que se arrastra de forma crónica. Hay diversos problemas reproductivos, como son reabsorciones después de la ecografía, abortos en sangre o con fetos muy pequeños, abortos más tardíos, malformaciones... Aunque se utilizan tratamientos sistemáticos antibióticos en gestación, los resultados no son adecuados.
Cuando llega este caso, en nuestro laboratorio ya disponíamos de historial en el que se observaba unas situaciones realmente plurietiológicas y complejas, con seropositividades a clamidias y fiebre Q, aunque con placentas investigadas por PCR en las que se descarta la presencia tanto de clamidias como de fiebre Q. También hay animales seropositivos a toxoplasmas y también la seropositividad a virus Border. En 2017 hay otro chequeo serológico, con títulos importantes a toxoplasma y virus Border. Además, se detecta un aborto por virus Border en julio de 2017, un Serocheck en machos que da una prevalencia del 68% a virus Border y una serología en corderas centinelas de siete meses en los que no aparece ningún animal seropositivo. Este hecho puede indicar que no está circulante el virus en el rebaño en ese momento o que aún no han tenido contacto al ser tan jóvenes con el animal PI del rebaño. Es un buen punto de partida para utilizar esa población centinela para hacer chequeos en el futuro. Se hace en noviembre un chequeo a esas mismas corderas centinelas, y nos encontramos que tres de esas siete corderas que quedaban en la explotación eran positivas. Se puede constatar una seroconversión y, al ser un rebaño cerrado, se puede afirmar con plenas garantías que hay animales persistentemente infectados en el rebaño.
Se establecen diferentes estrategias de actuación. En primer lugar, la búsqueda y eliminación de PI, con el objetivo de erradicar la enfermedad. En segundo lugar se establece una vacunación para reducir la tasa de abortos y mejorar la fertilidad, pensando en el corto plazo, mientras se realiza la búsqueda de PI y en previsión de que esa búsqueda no permita detectar a todos los PI del rebaño. Finalmente se hace un seguimiento para confirmar la eliminación de la enfermedad.
¦ Vacunación
Respecto a la vacunación, no existe una vacuna comercial frente al virus Border, pero se ha establecido desde hace años la hipótesis de una protección cruzada utilizando una vacuna de bovino del BVDV. Hay trabajos a nivel clínico que no establecen con claridad una eficacia importante, pero hay otros en los últimos años de grupos franceses que sí son prometedores por lo que se refiere a vacunar frente al virus Border con vacunas de bovino.
Estos trabajos demuestran que la vacuna del genotipo bovino induce la producción por parte de los animales de anticuerpos neutralizantes, que en los primeros meses post-vacunales son igual de eficaces en la neutralización del genotipo bovino que del genotipo ovino y que únicamente a partir del cuarto o quinto mes tras la vacunación, la eficacia puede ser peor en ovino que en vacuno. También establecen diferencias de eficacia según la dosis que se emplee. Así, media dosis respecto al vacuno es más eficaz que un cuarto de dosis. Además, algunos estudios reflejan mejoras en la fertilidad a primera inseminación y reducción de corderos nacidos con anormalidad.
En este caso, se decidió que, durante la época que durara la búsqueda de portadores, podía ser una buena medida preventiva vacunar con Bovilis BVD, a raíz de un mililitro por dosis, con una primovacunación, una revacunación posterior a los 28 días y, posteriormente, revacunar cada seis meses.
¦ Búsqueda de PI
Respecto a la identificación de PI, se establecieron dos estrategias diferentes. Una fue aprovechar la excreción del virus de leche por parte de los PI y buscarlos en leche de tanque o por lotes, con el abaratamiento de costes que supone. Con los animales secos y la recría, se buscaron utilizando ‘pooles’ de sangre mediante técnica de detección de PCR.
La excreción del virus por parte del PI en leche está perfectamente documentada. De hecho, en vacuno se utiliza como monitoreo de animales portadores de BVD en las explotaciones, pero no se sabe con qué sensibilidad puede funcionar en ganado ovino. Antes de este estudio, hemos realizado varias pruebas de dilución de leche de un animal PI en un número creciente de animales, para saber hasta dónde puede llegar la sensibilidad de detección de un animal PI en una leche de colectivo. En una dilución de 1 a 2.000, el PCR fue capaz de detectar el PI. En otro ensayo posterior, se dieron resultados muy similares, con una PCR ya negativa en una dilución de 1 a 3.000. Evidentemente, las curvas de PCR van descendiendo y pueden llegar a ser más difícilmente interpretables, pero se trata de sensibilidades importantes.
Para el monitoreo rutinario de explotaciones, la leche de tanque puede ser una alternativa interesante y prácticamente despreciable en precio para detectar rebaños positivos. Pero cuando ya sabemos que hay un rebaño positivo y se busca PI a través de leche, no debemos ser tan arriesgados de trabajar con mezclas tan grandes, sino que se debe trabajar con mezclas de menos animales. Los resultados de PCR en tanque en esta explotación se hicieron recogiendo leche de cinco días consecutivos, juntando ‘pooles’ de leche por lotes. La paridera de febrero fue negativa en PCR, la de mayo también fue negativa. También se hizo un PCR de animales paridas en agosto y también negativo. En leche no se encontró ningún portador.
Faltaba por intentar detectar PI en el resto de los animales, que son los que no habían parido y en las corderas de reposición. Los animales PI también eliminan de forma persistente el virus en sangre. Hicimos algunos estudios de dilución en suero y sangre en un número creciente de animales. También hay trabajos en vacuno que establecen el programa con ‘pooles’ de forma satisfactoria, ya que se detecta perfectamente un PI en sangre de hasta 100 animales. Un segundo ensayo dio resultados similares, así como el tercero. Lo hicimos en ovino y nos encontramos con resultados muy satisfactorios, encontrando PI en diluciones de 1.000, 200 o 500 animales. De todos modos, no se debe trabajar con ‘pooles’ tan amplios, por el nivel de riesgo y de sensibilidad de las técnicas, y porque además desde un punto de vista operativo en el laboratorio no es interesante, ya que con un ‘pool’ positivo después se tiene que chequear un gran número de animales de forma individual. En este sentido, se hizo un estudio de eficacia y coste para optimizar los ‘pooles’ por PCR, con diferentes posibilidades en función del tamaño del rebaño, el tamaño de los ‘pooles’ y al número de PI que se podían encontrar hipotéticamente, estableciendo más o menos un precio unitario del coste del análisis del animal de forma individual con un test ELISA de detección de antígeno, y el coste de un PCR que puede ser unas cinco veces el coste unitario de ELISA. Concluíamos que en la práctica totalidad de alternativas, los lotes de entre 20 y 25 animales eran la forma óptima de optimizar los costes a la hora de buscar PI en una explotación.
Se buscó el virus con PCR en sangre en lotes de 38 animales, que eran todos los que no estaban paridos. Se detectaron dos ‘pooles’ positivos y, en cada uno de ellos, había un animal positivo, por lo que detectamos únicamente dos animales positivos persistentemente infectados. Eran animales completamente normales y sanos a priori, aunque es cierto que ninguno de ellos tenía descendencia en el rebaño, lo que puede indicar que tenían problemas de fertilidad o un sesgo productivo que indica que no tuvieran hijas vivas en el rebaño. Una de esas ovejas estaba gestante en ese momento y decidimos mantenerla aislada y que pariera para poder examinar al cordero.
Se confirmó que eran PI a través del análisis de la excreción del virus. Se tuvo en cuenta que los dos animales portadores podían ser virémicos transitorios, por lo que podían estar en vías de superar la enfermedad. Por lo tanto, se estudió la excreción del virus desde la detección y se buscó el virus de nuevo a los 30 días. Si un mes después seguían siendo virémicos, podíamos confirmar que se trataba de PI. Estudiando la excreción en heces, orina, lavado tráqueo-broncales e hisopos nasales, en todos los casos hubo PCR positiva 30 días después. Este hecho se ha repetido en otros PI que hemos investigado de otras explotaciones.
Se tiene establecido que un animal PI engendra otro animal PI cuando el cordero es viable. Para comprobarlo, dejamos que pariera ese animal que habíamos detectado. Con sangre, plasma, hisopo rectal e hisopo nasal, todos los análisis dieron positivo. Por lo tanto, un PI engendró un PI. Las muestras se estudiaron hispatológicamente y se detectó una presencia masiva del virus en todos los órganos del animal (pulmón, riñón, abomaso, mucosa intestinal...) y ausencia prácticamente total de lesiones en dichos órganos. Por lo tanto, se observó que había órganos invadidos por el virus, pero sin lesiones.
¦ Seguimiento
Para cerrar el caso, se hizo un seguimiento. Quedaban por investigar las corderas que hubieran nacido recientemente y que estuvieran previamente en el útero materno durante todo el proceso de búsqueda de portadores.
Se hizo una búsqueda en esos animales, cuando todas las corderas cumplieron más de seis meses de edad. Es interesante muestrear las corderas cuando han superado esa edad, porque durante el periodo en el que los animales tienen anticuerpos maternos de origen calostral se puede producir una inhibición de la viremia. Por lo tanto, los resultados pueden ser negativos a PCR. Se puede hacer antes, para eliminar cuanto antes los PI del rebaño, aunque es recomendable hacer una comprobación cuando hayan llegado a los seis meses de edad. De hecho, en algunos animales jóvenes la viremia no es generalizada, por lo que puede haber PCR positivo en sangre, pero negativo en suero, por lo que se recomienda especialmente en estos animales trabajar con sangre entera, antes que con suero o con plasma.
En el seguimiento final, además de verificar que en las corderas de reposición no había PI, se hizo un nuevo chequeo en las mismas corderas centinelas en marzo de 2018 y volvimos a encontrar las mismas tres positivas. Por lo tanto, confirmamos que en este lote no había habido ninguna seroconversión, que es un dato importante porque habían transcurrido los suficientes meses para que estas corderas entraran en el preparto y se mezclaran con el ganado adulto.
Finalmente, se realizaron varios abortes de análisis en los que no ha habido presencia del virus Border y se mantiene un análisis de la leche de tanque.
CONCLUSIONES
- Los pestivirus en ovino están ampliamente distribuidos en nuestra cabaña y son causa de problemas reproductivos.
- La presencia de animales PI, en muy escaso número, puede pasar totalmente desapercibida debido a la ausencia de signos clínicos, y supone una fuente permanente de infección fetal para hembras gestantes, especialmente en los lotes de reposición.
- El análisis periódico de leche de tanque (PCR y ELISA-Ac) permite un monitoreo sencillo y económico de la presencia del virus en los rebaños. Es recomendable complementarlo con el seguimiento serológico de una población centinela de animales.
- La alta sensibilidad de la PCR permite trabajar con ‘pooles’ de sangres. Hace viable económicamente un plan de erradicación basado en búsqueda y eliminación de PI. También permite analizar a bajo coste lotes de animales antes de su entrada en un rebaño.
- Ante la sospecha firma de presencia de PI, los ‘pooles’ de 20-25 animales presentan una buena optimización de costes.
- Los animales PI excretan masivamente el virus por todas las vías posibles de contagio (oro-nasal, fecal, vaginal, urinaria).
- Los animales PI jóvenes con anticuerpos de origen calostral pueden tener una viremia inhibida o neutralizada. Es conveniente trabajar con ‘pooles’ de muestras más pequeños y con sangre entera (con anticoagulante). Conviene repetir analítica al superar los seis meses de edad.
REVISTAS
Oviespaña, noticias diarias sobre el mercado nacional e internacional del ovino, investigación ganadera, alimentación y sistemas de manejo.